|
RIASSUNTO
CONTESTO Il vaccino per il papillomavirus umano (HPV)-16/18 con
adiuvante AS04 era immunogenico, generalmente ben tollerato ed efficace
contro le infezioni da HPV-16 or HPV-18 e le lesioni precancerose associate
in un'analisi ad interim finalizzata agli eventi del trial PATRICIA
(PApilloma TRIal against Cancer In young Adults). E' stata valutata
l'efficacia del vaccino nell'analisi degli eventi finali.
METODI Lo studio di fase III multicentrico, in doppio cieco, randomizzato
ha coinvolto un totale di 18644 donne, di età compresa tra i 15
e i 25 anni, di 14 Paesi di Europa, Asia-Pacifico, America latina e America
del Nord. Le partecipanti sono state randomizzate per ricevere Cervarix
o un vaccino di controllo e le analisi sono state realizzate nelle seguenti
coorti: ATP-E (Coorte di valutazione di efficacia in accordo al protocollo,
vaccino n=8093; controlli n=8069), TVC (coorte vaccinata totale; vaccino
n=9319; controlli n=9325) e TVC-naive (vaccino n=5822; controlli n=5819).
ATP-E ha incluso tutte le donne che rispettavano i criteri di inclusione,
che hanno aderito completamente al protocollo e hanno ricevuto le tre
dosi di vaccino previste. TVC ha incluso le donne che hanno ricevuto almeno
una dose di vaccino. Questo gruppo ha coinvolto le diverse popolazioni
femminili, comprese quelle con evidenza di un'infezione pregressa da HPV
e quelle con alterazioni di grado elevato al Pap-test. L'intento era quello
di rappresentare la popolazione generale di giovani donne sessualmente
attive. TVC-naive ha incluso tutte le donne che hanno ricevuto almeno
una dose di vaccino e che non mostravano evidenze di infezione da HPV
pregressa o in atto. Questa popolazione rappresenta le giovani prima dell'inizio
dell'attività sessuale. L'end point primario era la valutazione
dell'efficacia del vaccino contro la neoplasia cervicale intraepiteliale
di grado 2 o più (CIN2+), associata a HPV-16 o HPV-18 in donne
sieronegative al basale.
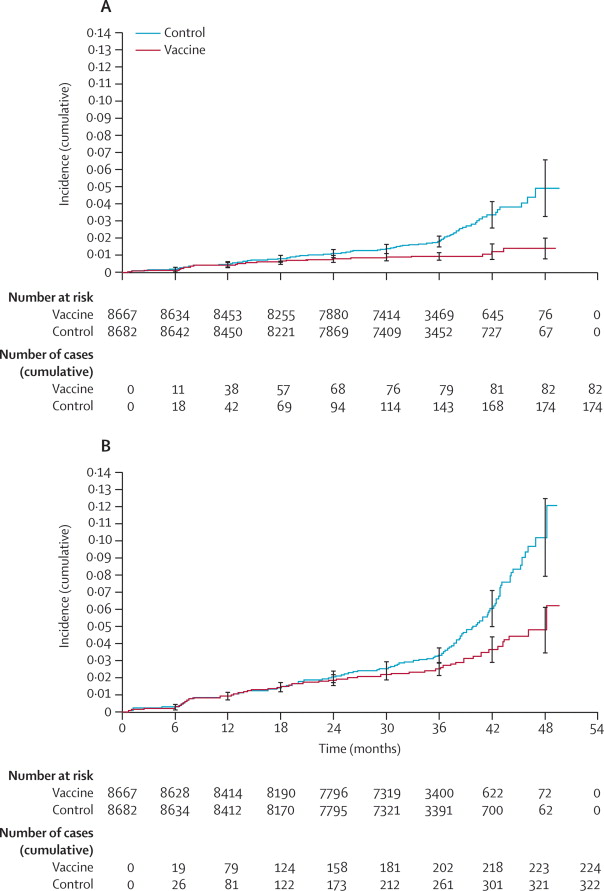
RISULTATI Il follow-up medio era di 34,9 mesi (DS 6,4) dopo la
terza dose. L'efficacia del vaccino nei confronti delle CIN2+ associate
con HPV-16/18 era pari al 92,9% (IC al 96,1% da 79,9 a -98,3) nella coorte
ATP-E. L'efficacia su CIN2+ indipendentemente dal DNA virale rinvenuto
nella lesione era di 30,4% (16,4-42,1) nella coorte TVC e 70,2% (54,7-80,9)
nella coorte TVC-naive. L'efficacia del vaccino nelle CIN2+ associate
con HPV 31, 33 e 45 -ceppi i cui antigeni non sono presenti nel vaccino-
è stata del 92% (da 66,0 a 99,2; p<0,0001), 51% (da -2,9 a 78,9;
p=0,0332) e 100% (da -67,8 a 100; p=0,0619) rispettivamente nella coorte
ATP-E. L'efficacia del vaccino nei confronti delle lesioni CIN2+ associate
con HPV 31, 33 e 45 è stata dell'68,4% (da 34,2 a 86,1; p=0,0005),
49,8% (da 4,8 a 76,6; p=0,0239) e 100% (da 7,0 a 100; p=0,0312) rispettivamente
nella coorte TVC. L'efficacia del vaccino nei confronti delle lesioni
CIN2+ associate ai 12 ceppi non presenti nel vaccino e non correlati con
l'insorgenza del tumore è stata del 54% (da 34,0 a 68,4; p<0,0001)
nella coorte ATP-E. Se si escludono tutte le lesioni CIN2+ associate con
ceppi non presenti nel vaccino nelle quali sono stati individuati virus
HPV 16 e 18, l'efficacia del vaccino è stata del 37,4 per cento
(da 7,4 a 58,2; p=0,0092) nella coorte ATP-E. Queste due analisi suggeriscono
che l'efficacia reale del vaccino nei confronti delle lesioni CIN2+ associate
con i 12 ceppi virali che non causano tumore è compresa tra il
37 e il 54%.
INTERPRETAZIONE Il vaccino per HPV-16/18 con adiuvante AS04 ha
mostrato un'elevata efficacia contro CIN2+ associato a HPV-16/18 e a ceppi
di HPV oncogenici non coperti dal vaccino e un rilevante effetto complessivo
nelle coorti significative per la vaccinazione di massa e per i programmi
di sensibilizzazione.
In una nota l'azienda rende noto che il profilo di tollerabilità
ha dato ampie garanzie, dal momento che negli studi clinici sono state
somministrate circa 45.000 dosi di Cervarix a circa 16.000 donne, di età
compresa tra i 10 e 68 anni che hanno riportato reazioni avverse comunemente
limitate a dolore nella zona di iniezione di lieve-moderata entità
e di breve durata. Al vaccino è stato un aggiunto un adiuvante
in grado di sostenere l'azione immunizzante a lungo termine. In questo
caso si tratta un elemento fondamentale del profilo di azione del vaccino
che deve tenere in conto il fatto che tumori e lesioni precancerose posso
presentarsi anche a distanza di decenni rispetto al momento dell'infezione.
COMUNICATO
GSK
Definizione
delle coorti di efficacia e di sicurezza.
TVC=coorte vaccinata totale. TVC-naive=coorte naïve vaccinata
totale.
TVC-E= coorte vaccinata totale per l'efficacia. ATP-E=coorte secondo il
protocollo per l'efficacia.

Incidenza cumulativa di neoplasia cervicale intraepiteliale di grado 2
o più (CIN2+) (A) associata a HPV-16/18 e (B) indipendentemente
dal DNA virale presente nella lesione
|
